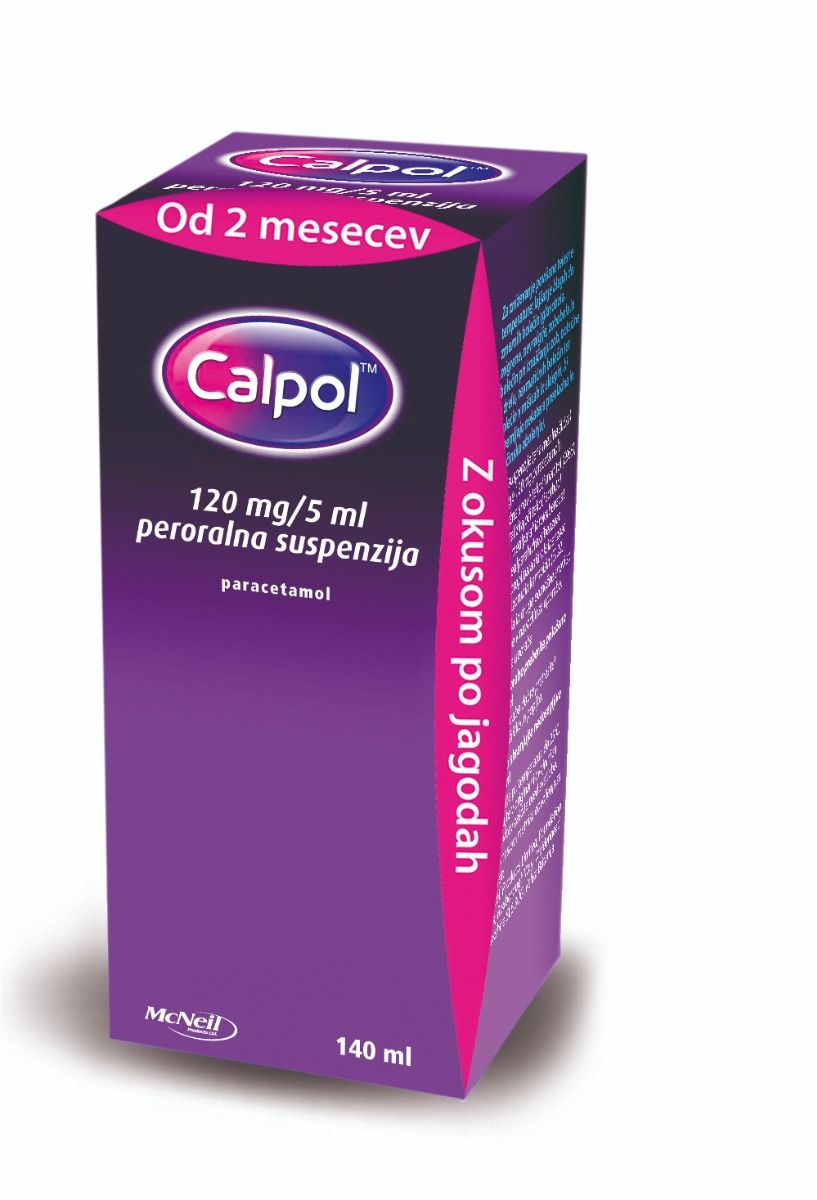
Calpol suspenzija 120 mg/5 ml, 140 ml
Calpol se porablja za simptomatsko lajšanje glavobola, migrene, nevralgije, zobobola in bolečin pri izraščanju zob, vnetja žrela, različnih revmatičnih bolečin, bolečin v mišicah in sklepih, ki spremljajo nekatera prehladna in vročinska obolenja.
1. IME ZDRAVILA
Calpol 120 mg/5 ml peroralna suspenzija
2. KAKOVOSTNA IN KOLIČINSKA SESTAVA
1 ml peroralne suspenzije vsebuje 24 mg paracetamola.
Ena merilna žlička zdravila (5 ml suspenzije) vsebuje 120 mg paracetamola.
Ena merilna žlička zdravila (2,5 ml suspenzije) vsebuje 60 mg paracetamola.
Priložena merilna žlička je podrobneje opisana v poglavju 6.5.
Pomožne snovi z znanim učinkom v 1 ml suspenzije:
tekoči maltitol (E965): 544 mg/ml
tekoči (nekristalizirajoči) sorbitol (E420): 136,5 mg/ml
metilparahidroksibenzoat (E218): 1 mg/ml
etilparahidroksibenzoat (E214): 0,4 mg/ml
propilparahidroksibenzoat (E216): 0,2 mg/ml
azorubin, karmoizin (E122): 0,015 mg/ml
propilenglikol (E1520) 2,864 mg/ml
Za celoten seznam pomožnih snovi glejte poglavje 6.1.
3. FARMACEVTSKA OBLIKA
peroralna suspenzija
Suspenzija roza barve z okusom po jagodah.
4. KLINIČNI PODATKI
4.1 Terapevtske indikacije
Calpol peroralna suspenzija je indicirana za zdravljenje blage do zmerne bolečine in kot antipiretik.
Uporablja se za simptomatsko lajšanje glavobola, migrene, nevralgije, zobobola in bolečin pri izraščanju zob, vnetja žrela, različnih revmatičnih bolečin, bolečin v mišicah in sklepih, ki spremljajo nekatera prehladna in vročinska obolenja.
4.2 Odmerjanje in način uporabe
Odmerjanje
Pediatrična populacija
Otroci, stari od 6 do 12 let:
Priporočamo uporabo Calpol 250 mg/5 ml peroralne suspenzije.
Otroci, stari od 1 do 6 let:
5 ml do 10 ml Calpol 120 mg/5 ml peroralne suspenzije (120 mg do 240 mg paracetamola), ki naj jih bolnik zaužije peroralno. Odmerek lahko ponovi po 4 urah.
Največji dnevni odmerek: 40 ml Calpol 120 mg/5 ml peroralne suspenzije (960 mg paracetamola).
Otroci, stari od 3 mesecev do 1 leta:
2,5 ml do 5 ml Calpol 120 mg/5 ml peroralne suspenzije (60 mg do 120 mg paracetamola), ki naj jih
bolnik zaužije peroralno. Odmerek lahko ponovi po 4 urah.
Največji dnevni odmerek: 20 ml Calpol 120 mg/5 ml peroralne suspenzije (480 mg paracetamola).
Otroci, mlajši od 3 mesecev:
Za vse indikacije v tej starostni skupini uporabo zdravila odobri zdravnik.
2,5 ml Calpol 120 mg/5 ml peroralne suspenzije (60 mg paracetamola) lahko date dojenčku, ki dobi
zvišano telesno temperaturo po cepljenju pri 2 mesecih starosti. Po potrebi lahko otroku date še drugi
odmerek 4 do 6 ur kasneje.
Trajanje zdravljenja:
Za otroke od 3 mesecev do 12. leta:
Indikacija bolečine: največ 5 dni.
Indikacija zniževanja povišane telesne temperature: največ 3 dni.
Uporaba zdravila Calpol več kot tri zaporedne dni pri indikaciji povišane telesne temperature in več kot pet zaporednih dni pri indikaciji bolečine je dovoljena samo pod zdravniškim nadzorom.
Jetrna insuficienca:
Pri dajanju peroralnih oblik zdravila Calpol posameznikom s hudo jetrno okvaro je potrebna previdnost (glejte poglavje 4.4).
Ledvična insuficienca:
Peroralne oblike zdravila Calpol morate uporabljati previdno pri bolnikih z zmerno do hudo ledvično
okvaro (glejte poglavje 5.2).
Način uporabe
Zdravilo se lahko jemlje neodvisno od obrokov hrane.
Pred uporabo zdravila Calpol pretresajte steklenico vsaj 10 sekund.
4.3 Kontraindikacije
Preobčutljivost na učinkovino ali katerokoli pomožno snov, navedeno v poglavju 6.1.
4.4 Posebna opozorila in previdnostni ukrepi
Če bolečina ali zvišana telesna temperatura ne mine ali se poslabša, ali če pride do novih simptomov, je potreben posvet z zdravnikom.
Zdravilo Calpol morate uporabljati previdno pri bolnikih s hudo jetrno okvaro in z zmerno do hudo ledvično okvaro.
Bolniki z obstoječo jetrno boleznijo, ki jemljejo tudi druga potencialno hepatotoksična zdravila, imajo zvišano tveganje za pojav hepatotoksičnih učinkov paracetamola (glejte poglavje 4.2 in 5.2). Pred uporabo zdravila Calpol naj se posvetujejo z zdravnikom.
Sočasno jemanje zdravila Calpol z drugimi zdravili, ki vsebujejo paracetamol, lahko pomeni preveliko odmerjanje paracetamola, zato se mu morate izogibati. Ob prevelikem odmerjanju lahko zdravilo Calpol povzroči poškodbe jeter. V primeru prevelikega odmerka je potrebno takoj poiskati zdravniško pomoč. Hitra zdravniška pomoč je ključnega pomena za odrasle kot tudi za otroke, tudi če ne opazite kakršnihkoli znakov ali simptomov.
V času zdravljenja z zdravilom Calpol uživanje alkohola odsvetujemo.
Zelo redko so poročali o resnih kožnih reakcijah, kot so akutna generalizirana eksantematozna pustuloza (AGEP), Stevens-Johnsonov sindrom (SJS) in toksična epidermalna nekroliza (TEN) pri bolnikih, ki so prejemali paracetamol. Bolnike je potrebno obvestiti o znakih resnih kožnih reakcij, in z uporabo zdravila je treba prenehati takoj ob prvem pojavu kožnih izpuščajev ali katerega koli drugega znaka preobčutljivosti.
Zaradi povečanega tveganja za presnovno acidozo z visoko anionsko vrzeljo (HAGMA-high anion gap
metabolic acidosis) je pri sočasni uporabi paracetamola in flukloksacilina priporočena previdnost, še
zlasti pri bolnikih s hudo okvaro ledvic, sepso, podhranjenih bolnikih, pri drugih stanjih, ki povzročajo
pomanjkanje glutationa (npr. kronični alkoholizem) in pri bolnikih, ki prejemajo najvišje dnevne
odmerke paracetamola. Priporočeno je natančno spremljanje bolnika, vključno z merjenjem 5-
oksoprolina v urinu.
Posebna opozorila o pomožnih snoveh:
Zdravilo vsebuje sorbitol. Če vam je zdravnik povedal, da vaš otrok ne prenaša nekaterih sladkorjev ali če so pri vašemu otroku ugotovili dedno intoleranco za fruktozo, redko genetsko bolezen, pri kateri ne more razgraditi fruktoze, se posvetujte z zdravnikom preden vaš otrok dobi to zdravilo. Sorbitol lahko povzroča nelagodje v prebavilih in ima blag odvajalni učinek. Kalorična vrednost je 2,6 kcal/g sorbitola.
Zdravilo vsebuje tekoči maltitol. Bolniki z redko dedno intoleranco za fruktozo ne smejo jemati tega zdravila. Pri uporabi odmerkov večjih ali enakih 18,4 ml peroralne suspenzije, je treba upoštevati, da je vsebnost tekočega maltitola enaka oziroma večja od 10 g maltitola. Lahko deluje blago odvajalno.
Kalorična vrednost je 2,3 kcal/g tekočega maltitola.
Zdravilo vsebuje estre parahidroksibenzojske kisline (metil-, etil- in propil-parahidroksibenzoat), ki
lahko povzročijo alergijske reakcije (lahko zapoznele).
Zdravilo vsebuje azorubin karmoizin, ki lahko povzroči alergijske reakcije.
To zdravilo vsebuje manj kot 1 mmol (23 mg) natrija na 5 ml, kar v bistvu pomeni ‘brez natrija’.
To zdravilo vsebuje 14,32 mg propilenglikola v 5 ml, kar je enako 2,86 mg/ml.
4.5 Medsebojno delovanje z drugimi zdravili in druge oblike interakcij
Pri bolnikih, ki so zaužili barbiturate, triciklične antidepresive ali alkohol, je lahko sposobnost za presnovo velikih odmerkov paracetamola zmanjšana, plazemska razpolovna doba paracetamola pa je lahko podaljšana. Pri sočasnem jemanju paracetamola in zdravil, ki inducirajo jetrne encime (npr. antiepileptiki fenitoin, fenobarbital in karbamazepin ter barbiturati in rifampicin), se poveča tvorba hepatotoksičnih presnovkov paracetamola.
Praznjenje želodca vpliva na količino absorbiranega paracetamola. Zato imajo lahko zdravila, ki delujejo na praznjenje želodca, vpliv na hitrost absorbcije paracetamola. Zdravila, ki spodbujajo gastrointestinalno gibanje kot sta metoklopramid in domperidon, lahko povečajo hitrost absorbcije paracetamola, medtem ko zdravila, ki zavirajo praznjenje želodca (npr. opoidni analgetiki) absorbcijo lahko odložijo. Holestiramin, ki v prebavilih veže žolčne kisline, lahko zmanjša absorpcijo paracetamola.
Alkohol lahko poveča hepatotoksičnost pri prekomernem odmerku paracetamola. Tako je lahko tudi prispeval k akutnemu pankreatitisu, o katerem so poročali pri enem bolniku, ki je zaužil prevelik odmerek paracetamola.
Kronično jemanje antikonvulzivov ali peroralnih kontraceptivov povzroči indukcijo jetrnih encimov in lahko prepreči doseganje terapevtske koncentracije paracetamola zaradi povečanja njegove presnove pri prvem prehodu skozi jetra ali zaradi povečanja njegovega očistka.
Pri sočasnem jemanju paracetamola in varfarina ter drugih kumarinov se poveča njihov antikoagulantni učinek, s čimer se poveča tveganje za krvavitev.
Pri sočasni uporabi paracetamola in flukloksacilina je potrebna previdnost, saj je bila sočasna uporaba povezana s pojavom presnovne acidoze z visoko anionsko vrzeljo, še zlasti pri bolnikih z dejavniki tveganja (glejte poglavje 4.4).
4.6 Nosečnost in dojenje
Nosečnost
Ni zadostnih in dobro nadzorovanih kliničnih študij o uporabi paracetamola pri nosečnicah in doječih ženskah. Epidemiološke študije kažejo, da paracetamol ne vpliva negativno na nosečnico, če se jemlje po predpisanih odmerkih. Epidemiološke študije o razvoju živčevja pri otrocih, izpostavljenih paracetamolu in utero, kažejo nejasne rezultate. Če nosečnica jemlje paracetamol po predpisanih odmerkih, ta prehaja skozi placento in je v plodovi krvi že 30 minut po jemanju. Plod učinkovito presnavlja paracetamol s sulfatno konjugacijo, vendar pa plod tudi katalizira nastanek aktivnega metabolita paracetamola z oksidacijo. Zato bi bil plod ogrožen, če bi prehajal velik odmerek zdravila v njegov obtok.
Zdravilo Calpol se ne sme uporabljati med nosečnostjo, razen če je možna korist zdravljenja za materjo večja od tveganja za razvijajoči plod. Če ste noseči, se pred uporabo zdravila posvetujte z zdravnikom.
Dojenje
Če doječa ženska jemlje paracetamol, se ta izloča v materino mleko v majhnih koncentracijah (0,1 % do 1,85 % prejetega odmerka). Terapevtski odmerki zdravila Calpol ne predstavljajo nevarnosti za dojene novorojenčke/otroke.
4.7 Vpliv na sposobnost vožnje in upravljanja strojev
Zdravilo Calpol nima vpliva ali ima zanemarljiv vpliv na sposobnost vožnje in upravljanja strojev.
Klinični podatki kažejo, da paracetamol ne vpliva na živčno-mišične učinke.
4.8 Neželeni učinki
Podatki po začetku trženja
Neželeni učinki, ki so bili identificirani v obdobju trženja pri terapevtskih odmerkih paracetamola, so navedeni spodaj. Navedene pogostnosti temeljijo na spontanih poročilih v skladu s sprejeto konvencijo:
Zelo pogosti ≥1/10
Pogosti ≥1/100 do <1/10
Občasni ≥1/1.000 do <1/100
Redki ≥1/10.000 do <1/1.000
Zelo redki <1/10.000
Neznana ni mogoče oceniti iz razpoložljivih podatkov
Bolezni imunskega sistema
Zelo redki: Anafilaktične reakcije, preobčutljivost
Bolezni kože in podkožja
Zelo redki: Urtikarija, srbeč izpuščaj, izpuščaj, medikamentni fiksni izpuščaj
Preiskave
Zelo redki: Zvišane vrednosti transaminaz*
*Pri nekaterih bolnikih, ki jemljejo predpisane odmerke paracetamola, se lahko pojavijo povišanja ravni transaminaze na nizki ravni; ta zvišanja niso povezana z jetrno odpovedjo in se običajno odpravijo z nadaljnjim zdravljenjem ali prekinitvijo paracetamola.
Poročanje o domnevnih neželenih učinkih
Poročanje o domnevnih neželenih učinkih zdravila po izdaji dovoljenja za promet je pomembno.
Omogoča namreč stalno spremljanje razmerja med koristmi in tveganji zdravila. Od zdravstvenih delavcev se zahteva, da poročajo o katerem koli domnevnem neželenem učinku zdravila na:
Javna agencija Republike Slovenije za zdravila in medicinske pripomočke
Sektor za farmakovigilanco
Nacionalni center za farmakovigilanco
Slovenčeva ulica 22
SI-1000 Ljubljana
Tel: +386 (0)8 2000 500
Faks: +386 (0)8 2000 510
e-pošta: h-farmakovigilanca@jazmp.si
spletna stran: www.jazmp.si
4.9 Preveliko odmerjanje
Znaki in simptomi prevelikega odmerjanja
Pri odraslih in mladostnikih (>12 let), ki so zaužili več kot 7,5 do 10 g paracetamola v 8-ih urah ali manj, se lahko pojavi jetrna toksičnost. Smrtne žrtve so redke (manj kot 3-4% nezdravljenih primerov) in o njih so redko poročali v povezavi s prevelikimi odmerki, manjšimi od 15 gramov. Pri otrocih (<12 let) akutni prevelik odmerek, manjši od 150 mg/kg, ni bil povezan z jetrno toksičnostjo.
Zgodnji simptomi zaradi potencialno hepatotoksičnega prevelikega odmerjanja lahko vključujejo: anoreksijo, slabost, bruhanje, prekomerno potenje, bledica in splošno slabo počutje. Klinični in laboratorijski znaki toksičnosti jeter morda niso jasni do 48 do 72 ur po zaužitju. Pri majhnih otrocih so bile zaradi akutnega prevelikega odmerka paracetamola resne toksičnosti ali smrtne žrtve zelo redke, morda zaradi različnih načinov presnavljanja paracetamola.
V naslednji tabeli so prikazani klinični dogodki, ki so povezani s prevelikim odmerjanjem paracetamola, in se štejejo za pričakovane, če se pojavijo skupaj s prevelikim odmerjanjem, vključno s smrtnimi dogodki zaradi fulminantne jetrne okvare ali posledic njenega nadaljevanja.
| Presnovne in prehranske motnje: | Zmanjšan tek |
| Bolezni prebavil: | Bruhanje, navzea, nelagodje v trebuhu |
| Bolezni jeter, žolčnika in žolčevodov: | Jetrna nekroza, akutna jetrna odpoved, zlatenica, hepatomegalija, občutljivost jeter |
| Splošne težave in razmere na mestu uporabe: | Bledica, hiperhidroza, slabost |
| Preiskave: | Povišan krvni bilirubin, povišani jetrni encimi, povišano mednarodno normalizirano razmerje, podaljšan čas protrombina, povišan krvni fosfat, povišan krvni laktat |
Pričakovane posledice akutne odpovedi jeter, povezane s prevelikim odmerjanjem paracetamola,
vključujejo naslednje: bakterijska okužba, glivična okužba, sepsa, koagulopatija, diseminirana
intravaskularna koagulacija, trombocitopenija, hipoglikemija, hipofosfatemija, laktacidoza, metabolna acidoza, možganski edem, koma (z obsežnim prevelikim odmerkom paracetamola ali večkratni
prevelik odmerek zdravila), encefalopatija, kardiomiopatija, hipotenzija, respiratorna odpoved,
gastrointestinalna krvavitev, pankreatitis, akutna poškodba ledvic in sindrom disfunkcije s številnimi
organi.
Hemolitična anemija: pri bolnikih s pomanjkanjem glukoze-6-fosfat dehidrogenaze so poročali o hemolizi pri uporabi prevelikega odmerka paracetamola.
Zdravljenje
V primeru prevelikega odmerjanja je treba takoj poiskati zdravniško pomoč.
Zdravljenje je simptomatsko. Specifični antidot pri prevelikem odmerjanju paracetamola je N-acetilcistein, ki ga je treba dati v prvih 12 urah po prevelikem odmerjanju.
Da bolnika zaščitimo pred pozno hepatotoksičnostjo, moramo preveliko odmerjanje paracetamola nemudoma zdraviti z ukrepi za omejitev absorpcije (izpiranje želodca ali uporaba aktivnega oglja), čemur naj sledi intravensko dajanje N-acetilcisteina ali peroralnega metionina. Metionina ne smemo uporabiti, če bolnik bruha, ali skupaj z aktivnim ogljem.
Čas doseganja največje plazemske koncentracije paracetamola je lahko zakasnjen za do 4 ure po zaužitju prevelikega odmerka, zato moramo za oceno tveganja hepatotoksičnosti plazemske koncentracije paracetamola meriti najmanj 4 ure po zaužitju zdravila. Glede na vsebnost paracetamola v krvi in čas, ki je minil od zaužitja zdravila, naj bolnik prejme še dodatno terapijo (dodaten metionin peroralno ali N-acetilcistein intravensko).
Predlagano je, naj se prag za odločitev za zdravljenje z N-acetilcisteinom zniža za 30 do 50 % pri bolnikih, ki jemljejo zdravila, ki inducirajo jetrne encime, pri osebah z dolgotrajno zlorabo alkohola ali pri kronično podhranjenih osebah, ker so lahko ti bolniki bolj občutljivi na toksične učinke paracetamola (glejte poglavje 4.5).
Pri fulminantni jetrni odpovedi, ki lahko nastopi po prevelikem odmerjanju paracetamola, je potrebno vodenje bolnika s strani specialista.
5. FARMAKOLOŠKE LASTNOSTI
5.1 Farmakodinamične lastnosti
Farmakoterapevtska skupina: Drugi analgetiki in antipiretiki, paracetamol
Oznaka ATC: N02BE01
Paracetamol je centralno delujoč, neopiatni, ne-salicilatni analgetik. Paracetamol je klinično dokazan analgetik in antipiretik. Menijo, da so terapevtski učinki paracetamola povezani z zavoro sinteze prostaglandinov kot posledica zavore encima ciklooksigenaze. Obstaja nekaj dokazov, da bolj učinkovito zavira ciklooksigenazo v osrednjem živčevju kot periferno ciklooksigenazo. Paracetamol ima le šibko protivnetno delovanje. To je mogoče razložiti s tem, da so vrednosti celičnih peroksidov v vnetih tkivih večje kot v drugih tkivih in da celični peroksidi preprečujejo zavoro ciklooksigenaze, ki jo povzroča paracetamol.
Paracetamol je klinično dokazan analgetik/antipiretik. Domneva se, da povzroči analgezijo s povišanjem praga bolečine ter z zmanjšanjem telesne temperature z delovanjem na hipotalamični center za uravnavanje temperature.
5.2 Farmakokinetične lastnosti
Absorpcija
Peroralni paracetamol se hitro in skoraj popolnoma absorbira iz gastrointestinalnega trakta, predvsem v tankem črevesju. Absorpcija poteka s pasivnim transportom. Biološka uporabnost se giblje od 85 % do 98 %. Pri posameznih odraslih se največje plazemske koncentracije pojavijo v 1 uri po zaužitju in se gibljejo od 14,8 do 17,6 μg/mL pri enkratnem odmerku 1000 mg. Največje plazemske koncentracije v stanju dinamičnega ravnovesja po 1000 mg odmerkih vsakih 6 ur se gibljejo od 17,6 do 18,2 μg/ml.
Študije enkratnega odmerka (12,5 mg/kg) paracetamola pri otrocih s povišano telesno temperaturo so
pokazale začetek zmanjšanja vročine v 15 do 30 minutah.
Učinki hrane
Sočasno jemanje paracetamola s hrano ne vpliva na obseg absorpcije paracetamola, vendar pa vpliva
na čas dosega najvišje plazemske koncentracije. Zaradi tega se za hitrejši učinek paracetamola
priporoča jemanje zdravila eno uro pred jedjo.
Porazdelitev
Paracetamol se enakomerno porazdeli po večini telesnih tkiv. Porazdelitveni volumen paracetamola pri otrocih in odraslih je ocenjen na 0,7 – 1 l/kg. Relativno majhen delež paracetamola (10-25 %) se veže na plazemske beljakovine.
Presnova
Presnova paracetamola poteka pretežno v jetrih in obsega tri glavne poti: konjugacijo z glukoronidom,
konjugacijo s sulfatom ter oksidacijo preko encima citokrom P450.
Pri presnovi paracetamola preko oksidativne poti se tvori reaktivni vmesni produkt N-acetil benzokinonimin, ki se veže z glutationom in se izloči kot merkapturna kislina ali pa se veže na cistein.
Poglavitni izoencim citokroma P450, ki je pri presnovi paracetamola vključen in vivo, je CYP2E1.
Izoencima CYP1A2 ter CYP3A4 imata pri presnovi paracetamola in vivo zanemarljiv prispevek.
Presnova paracetamola pri odraslih v večini poteka preko konjugacije z glukuronsko kislino ter v manjši meri s sulfatom. Pri presnovi z glukuronsko kislino, sulfatom in glutationom nastajajo neaktivni metaboliti.
Pri nedonošenčkih, novorojenčkih in mladih dojenčkih prevladuje sulfatni konjugat. Pri odraslih z
motnjami jeter z različno resnostjo in etiologijo je več študij o presnovi pokazalo, da je biotransformacija paracetamola podobna kot pri zdravih odraslih, a nekoliko počasnejša. Pri zdravih bolnikih in odraslih bolnikih z okvarjenim delovanjem jeter zaporedno dnevno odmerjanje 4 g na dan povzroči glukuronidacijo (metabolite, ki niso toksični), kar povzroči povečan celotni očistek paracetamola skozi čas in omejeno akumulacijo v plazmi.
Izločanje
Razpolovni čas izločanja paracetamola je pri odraslih približno 2 do 3 ure in približno 1,5 do 3 ure pri
otrocih. Pri novorojenčkih in pri bolnikih s cirozo je približno eno uro daljši. Paracetamol se iz telesa
izloči v obliki konjugatov glukuronske kisline (45-60 %), in sulfata (25-35%), tiolov (5-10 %), kot
cistein ali metaboliti merkapturne kisline, ali pa se izloči z urinom v obliki kateholov (3-6 %).
Ledvični očistek nespremenjenega paracetamola je približno 2-5 % odmerka.
Farmakokinetika pri ledvični okvari
Srednja razpolovna doba paracetamola v plazmi pri bolnikih z ledvično okvaro je podobna tisti pri
normalnih osebah v času od 2 do 8 ur po zaužitju odmerka, v času od 8 do 24 ur pa se paracetamol pri
bolnikih z ledvično okvaro izloča počasneje (zmerna okvara: očistek kreatinina < 0,5 ml/s
(30 ml/min)). Pri kronični ledvični odpovedi prihaja do znatnega kopičenja glukuronidnih in sulfatnih
konjugatov; lahko prihaja do nekaj dodatnega ledvičnega izločanja zadržanih konjugatov
paracetamola, z omejeno regeneracijo matične spojine. Pri odraslih bolnikih s kronično ledvično
odpovedjo je priporočeno povečanje razmika med posameznimi odmerki paracetamola. Hemodializa
lahko povzroči znižanje plazemske koncentracije paracetamola, zato so lahko potrebni dodatni
odmerki paracetamola za vzdrževanje terapevtskih koncentracij zdravila v krvi.
Farmakokinetika pri jetrni okvari
Srednja razpolovna doba paracetamola v plazmi pri bolnikih z blago jetrno okvaro je podobna tisti pri
normalnih osebah, pri bolnikih s hudo jetrno okvaro pa je znatno večja (približno 75 %). Klinični
pomen podaljšanja razpolovne dobe ni jasen, ker pri bolnikih z jetrno okvaro ni nobenih znakov
kopičenja ali hepatotoksičnosti zdravila in tudi konjugacija z glutationom ni zmanjšana. Pri 20
preiskovancih s stabilno kronično jetrno boleznijo jemanje 4 g paracetamola na dan v času 13 dni ni
povzročilo nikakršnega poslabšanja delovanja jeter. Pri blagi jetrni okvari ni nobenih znakov, da bi bil
paracetamol škodljiv pri jemanju v priporočenih odmerkih, pri hudi jetrni okvari pa je razpolovna
doba paracetamola v plazmi bistveno daljša.
Farmakokinetika pri otrocih
Študije so pokazale, da je pri novorojenčkih, starih od 0 do 2 dni, in pri otrocih, starih od 3 do 10 let,
paracetamol sulfat poglavitni presnovek paracetamola. Podatki, dobljeni pri odraslih in otrocih, starih
12 let ali več, kažejo, da je glavni presnovek glukoronidni konjugat. Vendar pa pri različnih starostnih
skupinah ni nobenih bistvenih razlik v skupni hitrosti izločanja paracetamola ali v skupni količini
zdravila, ki se izloči z urinom.
5.3 Predklinični podatki o varnosti
Povzetek:
Predklinični podatki ne kažejo nobenega posebnega tveganja za človeka na podlagi študij toksičnosti enkratnega in ponavljajočih se odmerkov ter študij genotoksičnosti, rakotvornosti in toksičnosti za razmnoževanje in razvoj.
Odmerki, pri katerih je vidna reproduktivna toksičnost ali učinki na plodnost, so veliko višji od
priporočenih odmerkov pri ljudeh.
Splošna toksičnost
Številne študije akutnih, subakutnih in kroničnih toksičnosti pri živalih kažejo, da se toksični učinki
paracetamola pojavijo le pri odmerkih, ki so znatno višji od priporočenih.
Toksičnost enkratnega in ponavljajočih odmerkov
Toksičnost paracetamola je bila obsežno raziskana na različnih živalskih vrstah.
V predkliničnih študijah so ugotovili, da je enkratni peroralni odmerek LD50 pri miših okoli 400 do 900 mg/kg telesne mase in pri podganah 2000 mg/kg telesne mase. Kronična toksičnost (uporabljali so mnogokratnike terapevtskih odmerkov pri človeku) se pri teh živalskih vrstah kaže kot degeneracija in nekroza jetrnega, ledvičnega in limfatičnega tkiva ter sprememb v krvni sliki.
Genotoksičnost
Ob upoštevanju študij in vitro in in vivo, celovitega in dokončnega pregleda, ki ga je sprejel Odbor za
lastniške medicinske izdelke (CPMP) Evropske unije, poročajo, da se genotoksični učinki paracetamola pojavljajo le pri odmerkih, ki povzročajo izrazito toksičnost jeter in kostnega mozga, in da mejna vrednost za genotoksičnost ni dosežena v predlaganih odmerkih.
Mutagenost
Za paracetamol so testi mutagenosti na bakterijah pokazali, da ni mutagen, četudi so opažali jasen klastogeni učinek v sesalskih celicah in vitro po njihovi izpostavljenosti paracetamolu (3 in 10 mM v času 2 ur). In vivo testi mutagenosti paracetamola pri sesalcih so omejeni in so dali nasprotujoče si rezultate, zato so podatki za oceno, ali pomeni paracetamol tveganje mutagenosti pri človeku, nezadostni.
Kancerogenost
Na podlagi več dolgoročnih študij na živalih paracetamol ne kaže na kancerogen potencial pri
odmerkih, ki niso hepatotoksični.
Teratogenost
Pri podganah ali miših niso ugotovili teratogenosti paracetamola.
Vpliv na sposobnost razmnoževanja in razvoj
Običajne študije z uporabo trenutno sprejetih standardov vrednotenja toksičnosti za razmnoževanje in razvoj niso na voljo.
6. FARMACEVTSKI PODATKI
6.1 Seznam pomožnih snovi
tekoči maltitol (E965)
tekoči (nekristalizirajoči) sorbitol (E420)
glicerol (E422)
mikrokristalna celuloza (E460)
natrijev karmelozat
ksantanski gumi (E415)
etilparahidroksibenzoat (E214)
metilparahidroksibenzoat (E218)
propilparahidroksibenzoat (E216)
aroma jagode (propilenglikol (E1520))
azorubin, karmoizin (E122)
polisorbat 80 (E433)
prečiščena voda
6.2 Inkompatibilnosti
Calpol suspenzije ne smete redčiti.
6.3 Rok uporabnosti
3 leta
6.4 Posebna navodila za shranjevanje
Shranjujte pri temperaturi do 25°C.
Shranjujte v originalni ovojnini za zagotovitev zaščite pred svetlobo.
6.5 Vrsta ovojnine in vsebina
Vrsta ovojnine: V škatli je priložena steklenica in dvodelna merilna žlička. Steklenica iz
stekla (hidrolitska odpornost tip III) je jantarjeve barve, zaprta z dvodelno za otroke varno zaporko iz
polipropilena in pokrovčkom iz polietilena ali poliviniliden klorida. Dvodelna merilna žlička iz
polipropilena ima večjo žličko prostornine 5 ml, manjšo pa 2,5 ml.
Vsebina: 140 ml peroralne suspenzije.
6.6 Posebni varnostni ukrepi za odstranjevanje
Neuporabljeno zdravilo ali odpadni material zavrzite v skladu z lokalnimi predpisi.
7. IMETNIK DOVOLJENJA ZA PROMET
McNeil Healthcare (Ireland) Limited, Block 5, High Street, Tallaght, Dublin 24, Irska
8. ŠTEVILKA (ŠTEVILKE) DOVOLJENJA (DOVOLJENJ) ZA PROMET Z ZDRAVILOM
H/99/00328/001
9. DATUM PRIDOBITVE/PODALJŠANJA DOVOLJENJA ZA PROMET
Datum pridobitve dovoljenja: 07.05.1999
Datum podaljšanja dovoljenja za promet: 20.07.2010
10. DATUM ZADNJE REVIZIJE BESEDILA
| Proizvajalec | GLAXOSMITHKLINE |
|---|